Obsah
- Hlavní rozdíl
- Srovnávací tabulka
- Co jsou iontové sloučeniny?
- Co jsou to molekulární sloučeniny?
- Iontové sloučeniny vs. molekulární sloučeniny
Hlavní rozdíl
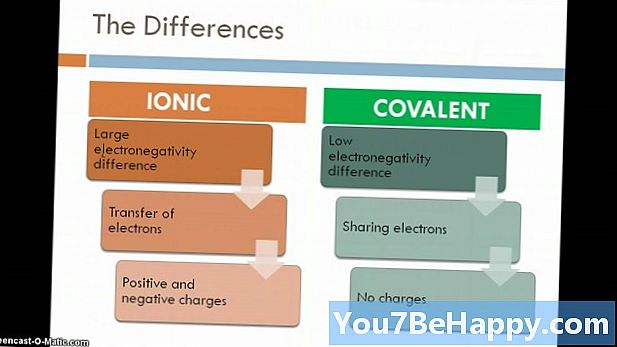
Sloučenina je rozpoznána jako látka, která se vytvoří, když se dva nebo více prvků spojí dohromady v určitém poměru prostřednictvím chemické vazby. Iontová sloučenina je sloučenina tvořená elektrostatickou silou přitahování mezi kovy a nekovy. Obvykle se iontové sloučeniny objevují v prodaném krystalickém stavu. Kromě toho jsou iontové sloučeniny dobrými vodiči elektřiny a mají vysoké teploty tání a teploty varu. Na druhé straně se molekulární sloučeniny vytvářejí díky sdílení elektronů mezi dvěma nekovy. Ve vztahu k iontové sloučenině jsou špatným vodičem elektřiny a mají nízkou teplotu tání a teplotu varu.
Srovnávací tabulka
| Iontové sloučeniny | Molekulární sloučeniny | |
| Formace | Iontové sloučeniny se vytvářejí v důsledku elektrostatické síly přitahování mezi kovy a nekovy. | Molekulární sloučeniny se tvoří díky sdílení elektronů mezi dvěma nekovy. |
| Skupina | Iontové sloučeniny se vytvářejí mezi kovem a nementálními. | Molekulární sloučeniny se tvoří, když se dva nekovy chemicky kombinují |
| Pouto | Iontová sloučenina je tvořena díky elektrostatické přitažlivosti známé jako iontová vazba. | Molekulární sloučeniny se tvoří díky kovalentní vazbě mezi elementy. |
| Bod tání a bod varu | Vysoký | Nízký |
| Stát | Iontové sloučeniny jsou vždy v pevném stavu a vytvářejí krystalický vzhled. | Molekulární sloučeniny mohou být při teplotě místnosti v jakémkoli stavu, pevné, kapalné nebo plynné. |
| Dirigent elektřiny | Dobrý | Špatný |
Co jsou iontové sloučeniny?
Tyto sloučeniny se vytvářejí v důsledku elektrostatické síly přitahování mezi kovy a nekovy. Zjednodušeně řečeno, síla (iontová vazba) v tomto způsobuje, že pozitivně a negativně nabité reagují společně za vzniku sloučeniny. Obvykle se iontové sloučeniny objevují v prodaném krystalickém stavu a jsou dobrými vodiči elektřiny s vysokou teplotou tání a teplotou varu. Iontové sloučeniny se tvoří mezi kovy a nekovy a mají nějaký lesklý vzhled.
Příklad: Stolní sůl (NaCl) je nejběžnějším příkladem iontové sloučeniny. V této formaci je sodík (NA) kov, zatímco chlor (Cl) je nekovový, oba jsou drženy pohromadě kvůli elektrostatické síle přitahování mezi nimi.
Co jsou to molekulární sloučeniny?
Sloučeniny vytvořené v důsledku sdílení elektronů mezi nekovy jsou známé jako Molecular Compound. Prvky, které zde reagují, jsou drženy pohromadě díky kovalentní vazbě, a proto jsou tyto sloučeniny často označovány jako kovalentní sloučeniny.Ve vztahu k iontové sloučenině jsou špatným vodičem elektřiny a mají nízkou teplotu tání a teplotu varu.
Příklad: V ozónu (O3) se kyslík kombinuje se sdílením elektronů za vzniku ozonu.
Iontové sloučeniny vs. molekulární sloučeniny
- Iontové sloučeniny se vytvářejí v důsledku elektrostatické síly přitahování mezi kovy a nekovy, zatímco Molekulární sloučeniny se vytvářejí díky sdílení elektronů mezi dvěma nekovy.
- Molekulární sloučeniny se vytvářejí, když se dvě nekovové sloučeniny chemicky kombinují, na druhé straně se vytvářejí iontové sloučeniny mezi kovem a nementální.
- Molekulární sloučeniny se tvoří díky kovalentní vazbě mezi elementy, zatímco iontová sloučenina se vytváří díky elektrostatické síle přitažlivosti známé jako iontová vazba.
- Molekulární sloučeniny mají ve srovnání s iontovými sloučeninami nízkou teplotu tání a teplotu varu.
- Molekulární sloučeniny mohou být při teplotě místnosti v jakémkoli stavu, pevné, kapalné nebo plynné, zatímco iontové sloučeniny jsou vždy v pevném stavu a vytvářejí krystalický vzhled.
- Molekulární sloučeniny jsou špatným vodičem elektřiny, zatímco iontové sloučeniny jsou dobrým vodičem elektřiny.